Sáng nay (7/8), các cơ quan chức năng của Bộ Y tế đã có cuộc họp với nhóm nghiên cứu vaccine Nanocovax, đánh giá giai đoạn 1, 2 của thử nghiệm lâm sàng trên người.
Phản ứng sau tiêm thấp hơn các vaccine đang lưu hành
Theo báo cáo của Học viện Quân y - đại diện nhóm nghiên cứu thử nghiệm lâm sàng: kết quả thử nghiệm giai đoạn 1-2-3 cho thấy vaccine an toàn. Giai đoạn 1 theo dõi với các phản ứng phản vệ từ độ 1, không ghi nhận trường hợp phản ứng. Giai đoạn 2-3 ghi nhận 1 trường hợp phản vệ độ 2. Còn lại là các phản ứng thông thường như đau tại vết tiêm, sưng vết tiêm, sốt nhẹ...
Tỷ lệ người tiêm gặp các phản ứng từ thông thường đến nặng đều thấp hơn các vaccine đang lưu hành.
Ở giai đoạn 3 của thử nghiệm lâm sàng, nhóm nghiên cứu đã hoàn tất tiêm mũi 2 cho 1.000 người tham gia thử nghiệm giai đoạn 3a và đã lấy mẫu gửi đánh giá độc lập tại Viện Vệ sinh dịch tễ trung ương. 12.000 người tiêm giai đoạn 3b đã hoàn tất mũi 1, hiện đang tiêm mũi 2 và trước 15-8 sẽ hoàn tất mũi 2.
Báo cáo cũng có so sánh kháng thể bảo vệ ở người được tiêm vaccine Nanocovax và kháng thể ở nhóm bệnh nhân mắc COVID-19 đã khỏi bệnh. Kết quả cho thấy kháng thể sau 42 ngày tiêm mũi 1 (D42) ở người tiêm Nanocovax cao gấp 10 lần so với người mắc COVID-19 đã khỏi bệnh.
Hiệu lực bảo vệ - điều kiện để được cấp phép khẩn cấp
Đến thời điểm này (7/8) Hội đồng Đạo đức trong nghiên cứu y sinh học Quốc gia vẫn chưa nhận được hồ sơ, báo cáo chính thức nào từ các nghiên cứu viên chính và Tổ chức nhận thử về hiệu lực bảo vệ của vaccine Nanogen.
Các dữ liệu công bố từ phía Công ty Nanogen trên trang BioRxiv (vào ngày 20 tháng 7) và MedRxiv (vào ngày 22 tháng 7) cho thấy kháng thể tạo ra từ việc tiêm vaccine có thể nhận biết virus và ngăn cản chúng nhiễm vào tế bào nhưng không cho thấy được hiệu quả đó là bao nhiêu.
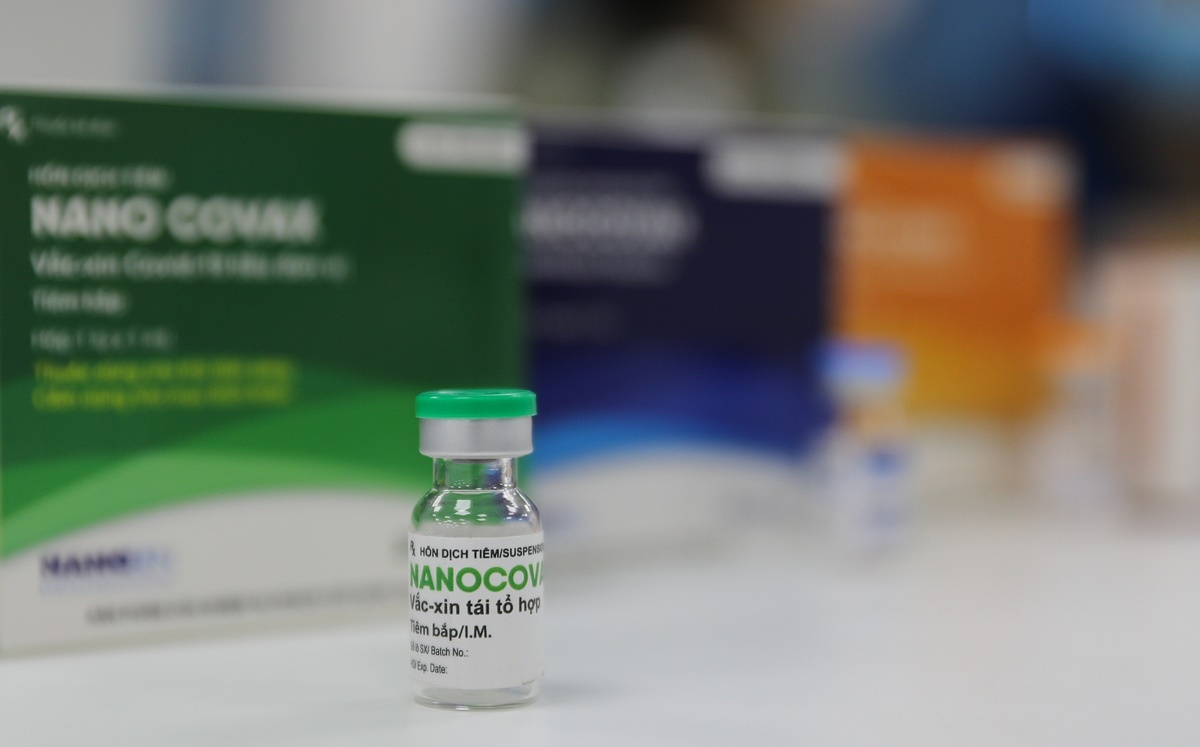
Trao đổi với phóng viên VOV2 về vấn đề này, đại diện của Học viện quân y – đơn vị đang tiến hành nghiên cứu thử nghiệm lâm sàng cho biết, để đủ điều kiện cấp phép, cần chứng minh được tính “hiệu quả” của vaccine trong việc ngăn ngừa lây nhiễm virus. Tuy nhiên, với Nanocovax yêu cầu này vẫn cần thời gian và các bên nghiên cứu vẫn đang “đợi”.
Đại diện Học viện Quân y cũng cho biết: như các vaccine đời đầu, để đánh giá được hiệu lực bảo vệ cần có các ca bệnh để tham gia so sánh hiệu quả bảo vệ. Với 13.000 người tham gia thử nghiệm, yêu cầu với Nanocovax là cần “bắt” được 150 ca bệnh để từ đó có mẫu đối chiếu với các nhóm khác, và với chỉ tiêu này, có thể phải đợi đến cuối năm nay các đơn vị tham gia nghiên cứu, thử nghiệm mới có thể đáp ứng yêu cầu.
Phía Học viện Quân y cũng cho rằng, có thể tiến hành tiêm vaccine rộng rãi ở những vùng dịch đang lưu hành mạnh hiện nay để có thể đánh giá được hiệu quả bảo vệ. Tuy nhiên, 5 tỉnh thành phố đề nghị được tham gia tiêm thử nghiệm Nanocovax đã không được chấp thuận. Theo Bộ Y tế, quy định hiện hành không cho phép "dùng thử" vaccine, nếu tham gia thử nghiệm phải tuân thủ quy trình và đề cương đã được Bộ Y tế phê duyệt.
Tình hình dịch bệnh COVID-19 đang diễn ra phức tạp ở nhiều nơi trên thế giới nói chung và ở Việt Nam nói riêng. Việc tự chủ được nguồn vaccine trong nước là một điều cần làm vì nó sẽ giúp giảm bớt gánh nặng kinh tế, không phụ thuộc vào nguồn cung từ nước ngoài. Việc đưa vaccine Nanocovax vào danh sách các vaccine được Bộ Y Tế cho phép sử dụng khẩn cấp vì thế là cần thiết, cấp bách nhưng cũng cần phải đánh giá được độ an toàn và hiệu quả của vaccine này dựa trên các dữ liệu nghiên cứu khoa học.









